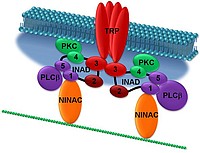
Die Rolle des INAD-Gerüstproteins innerhalb der Phototransduktion in Drosophila
Die Untersuchung der Rolle des Gerüstproteins INAD in der Sehkaskade von Drosophila wird in Zusammenarbeit mit der Arbeitsgruppe von Professor Baruch Minke an der Universität Jerusalem durchgeführt und von der German Israely Foundation for Research and Development (G.I.F.) gefördert.
Signalkomplexe, die aus mehreren Proteinen aufgebaut sind und von sogenannten Gerüstproteinen organisiert werden, spielen eine wichtige Rolle in Signalkaskaden. Sie können die Spezifität und auch die Geschwindigkeit der Signalübermittlung verbessern. INAD ist ein Gerüstprotein, das andere an der Phototransduktionskaskade von Drosophila beteiligte Proteine bindet. Die Bindung von INAD an TRP (transient receptor potential) führt zur Verankerung des Signalkomplexes in der Membran.
Mit Hilfe elektrophysiologischer Untersuchungen fand man heraus, dass die inaD-Mutante eine im Vergleich zum Wildtyp veränderte Elektrophysiologie aufweist. Da TRP nicht nur der Verankerung des Signalkomplexes in der Membran dient, sondern zugleich als Ionenkanal maßgeblich an der Entstehung des Rezeptorpotentials beteiligt ist, liegt der Schluss nahe, dass INAD die Eigenschaften des TRP-Kanals beeinflusst. Darum soll im Rahmen eines Projekts untersucht werden, welchen Stellenwert die Rekrutierung von Membrankanälen durch INAD hat. Hierbei sollen Kanäle mit modifizierten INAD-Interaktionsstellen transgen in Drosophila exprimiert und die entsprechenden Fliegen elektrophysiologisch charakterisiert werden.
Momentan werden posttranslationale Modifikationen des INAD-Proteins untersucht. Da INAD die Reizantwort maßgeblich beeinflusst, könnten reversible posttranslationale Modifikationen dazu dienen, die Reizantwort zu modellieren. Etwaige lichtabhängige posttranslationale Modifikationen von INAD werden mittels 2D-Gelelektrophorese und mit Hilfe von massenspektrometrischen Analysen identifiziert. Identifizierte Aminosäuren, die lichtabhängig modifiziert werden, sollen in einem zweiten Schritt mutiert werden. Das so veränderte INAD-Protein soll dann transgen in Drosophila exprimiert werden, um es einer in vivo-Analyse zugänglich zu machen.
